Miniaturbildübersicht Knochen
(Ossa)
+ Knochenbildung (Ossifikation):
Bereits bezeichnete Abbildungen lassen sich
durch Ankilcken des Textes aufrufen!
 |
 |
 |
 |
 |
 |
 |
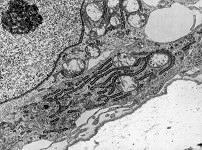
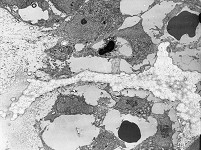
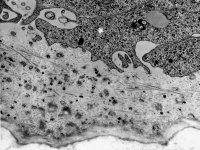
kaum aktive
Osteoblasten (Affe)
|
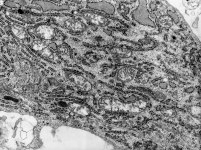
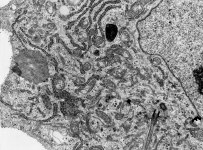
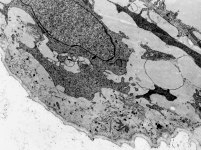
Organellen eines
Osteoblasten 1 (Affe)
|
Organellen eines
Osteoblasten 1 (Affe)
|
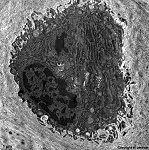
Osteozyt
(Ratte) |
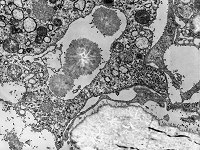
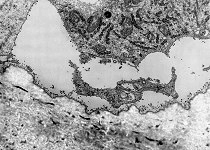
Eröffnungszone der
chondralen Ossifikation (Affe)
|
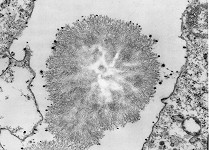
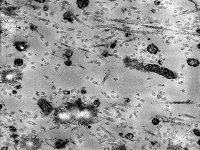
Kristallisationszentrum
(Affe)
|
Übersicht dazu |
 |
 |
 |
 |
 |
 |
|
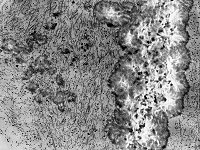
frisch gebildetes
Osteoid (Affe) |
Bildung von Osteoid 1 (Affe) |
frisches Osteoid
Detail (Affe) |
Bildung von Osteoid 2 (Affe) |
Bildung von Osteoid 3 (Affe) |
Osteozyt
(Ratte) |
Die insgesamt üblicherweise 210 Knochen (Terminologia
histologica: Ossa, englisch: bones) des Menschen bestehen aus Knochengewebe
(Terminologia histologica: Textus osseus, englisch: bone tissue). Man unterscheidet
dabei platte Knochen mit massiver = harter äußerer und innerer
Schicht von den länglichen, innen hohlen Röhrenknochen. Diese
weisen an ihren Enden (Epiphysen) mit hyalinem
Knorpel überzogene Gelenkflächen auf, darauf folgt eine maximal
3 mm dicke Schicht aus kompaktem Knochengewebe,
die Substantia corticalis, welche in spongiöses
Knochengewebe übergeht. Danach zeigt sich bis zum Abschluß
des Längenwachstums des betroffenen Knochens eine aus langsam sekundär
verknöcherndem
hyalinen Knorpel bestehende
Wachstumsfuge (Epiphysenfuge; Terminologia
histologica: Centrum ossificationis secundarium, Centrum ossificationis
epiphysiale; englisch: secondary ossification centre, epiphysial ossification
centre). Darunter folgt wieder spongiöser
Knochen im Übergangsbereich zum hohlen Schaft, der als Metaphyse
bezeichnet wird und schließlich der nur
noch aus bis maximal 15 mm dickem kompaktem
Knochengewebe, welches hier Substantia compacta genannt wird, bestehende
als Diaphyse oder Corpus bezeichnete Knochenschaft, dessen Inneres
von Knochenmark ausgefüllt wird (beim
Erwachsenen aus univakuolärem Fettgewebe
bestehendem Fettmark).
Zellen des Knochens:
Alle Knochengewebe bestehen aus Knochenzellen und der sie umgebenden
verknöcherten Bindegewebssubstanz. Man unterscheidet folgende Zellen:
Osteoblasten (Terminologia histologica:
Osteoblasti, englisch: osteoblasts) sind sehr stoffwechselaktiv und bauen
Knochen auf. Sie gehen aus mesenchymalen
Stammzellen hervor, die stimuliert durch Knochendifferenzierungsproteine
(bone morphogenitic proteins) zu bipotenten
Progenitorzellen werden. Letztere zeigen eine den Fibroblasten
ähnliche Morphologie und können sich entweder zum einem Chondroblasten
oder zu einem Präosteoblasten weiterentwickeln. Letztere differenzieren
sich dann zu Osteoblasten, was durch aktives Vitamin A (Retinsäure)
gefördert wird. Osteoblasten zeigen reichlich, zum Teil erweitertes
(dilatiertes) rauhes endoplasmatisches Retikulum
und sind daher basophil. In ihren Golgi-Apparaten
werden die Glykoproteine und Proteoglykane zur Abgabe in die Knochenmatrix
aus Proteinen durch Zuckerkopplung generiert. Die Zellmembran
der Osteoblasten zeigt reichlich alkalische Phosphatase. Wie die Osteozyten
auch stehen sie über Gap-junctions aufweisende
Fortsätze epithelartig miteinander in Verbindung. Zusätzlich
bilden sie auch Tight-junctions und lokal begrenzte
Zonulae
adhaerentes zueinander aus. Sie sezernieren das Osteoid
(Terminologia histologica: Stratum preosseum, Osteoideum; englisch: osteoid,
preosseus matrix), das noch weich und an
Grundsubstanz
sowie Tropokollagen
reich ist aus dem sich dann erste Kollagenfibrillen
extrazellulär bilden. Außerdem sezernieren Osteoblasten Substanzen,
die die Osteoklasten stimulieren und binden
sich auch an diese Zellen siehe
hier.
Parathormon hemmt die Osteoidsynthese und fördert die Bildung Osteoklasten
stimulierender Faktoren. Das vom Vitamin D abstammende Calcitriol stimuliert
ebenfalls die Osteoblastenaktivität.
Osteozyten (Terminologia histologica:
Osteocyti, englisch: osteocytes), die "eingemauerten" wenig stoffwechselaktiven
Knochenzellen, stehen über bis zu 200 µm lange, 150 nm dünne
Fortsätze (Terminologia histologica: Processus osteocyti, englisch:
osteocyte processes) und dort ausgebildete Gap-junctions
miteinander oder den Endothelzellen der Havers
Kanäle in Verbindung. Dabei verlaufen die Fortsätze in feinen,
bis zu 400 nm durchmessenden Kanälchen, die die Knochenmatrix
unterbrechen und Knochenkanalikuli (Terminologia histologica: Canalculi
ossis, englisch: bone canaliculi) genannt werden. Um ihr Lumen herum befindet
sich nicht verkalkte Matrix, die über Diffusion "ernährt" wird.
Das Zytoplasma der Osteozyten ist organellenärmer;
wenig und nur ausnahmsweise dilatiertes
rauhes endoplasmatisches
Retikulum, kleine Golgi-Apparate, wenig
Ribosomen.
Die Zellkörper der Osteozyten liegen in ca. 30 x 10 µm großen
länglich ovalen Aussparungen der Lamellen, die als Osteozytenlakunen
(Terminologia histologica: Lacunae oseocytorum; englisch: osteocyte lacunae)
bezeichnet werden.
Osteoklasten (Terminologia histologica:
Osteoclasti, englisch: osteoclasts) gehören zum mononucleären
(einkernigen) Phagozytensystem obwohl sie stets mehrkernige
(bis zu 25 Zellkerne) Riesenzellen (Durchmesser
30 - 100 µm) sind, weil sie aus fusionierten aus dem Blut
ausgewanderten
Monozyten (echte mononukleäre
Zellen) hervorgehen. Damit diese Zellen
zu einem Synzythium verschmelzen können, müssen sie als
osteoklastäre Progenitozellen mit ihren Osteoprotegerin-Rezeptor an
Osteoprogeterin-Liganden der Zellmembran von Osteoblasten
binden. Außerdem müssen CSF-1 (Colony stimulating factor 1),
Interleukin-1, -6, - 11, TNF-alpha und ProstaglandinE2 vorhanden
sein. Im Bereich des kompakten Knochengewebes
fressen sich an den Spitzen der Erosionstunnel
Osteoklasten in die Hartsubstanz vor, während sie an den Trabekeln
des spongiösen Knochengewebes Erosionslakunen
(Terminologia histologica: Lacunae erosionis, englisch: osteoclastic crypts,
erosion lacunae) bilden. In beiden Fällen bilden sie zur Knochensubstanz
hin einen Resorptionssaum aus. Dieser ist ein bürstenartiges
Büschel (Terminologia histologica: Limbus microplicatus, englisch:
ruffled border) mit kurzen Zellfortsätzen und/oder kleinen, die Oberfläche
vergrößernde Falten (Microplicae) ausbilden. Über die Ausschüttung
von Salzsäure in Richtung des mineralisierten Knochens werden die
dort eingelagerten Kalziumsalze zerstört und damit die Knochensubstanz
aktiv abgebaut. Über eine in die
Zellmembran
im Bereich des Resorptionssaums eingelagerte Wasserstoffionen ATPase werden
Protonen in Richtung Knochen gepumpt, während Chloridionen durch einen
Kanal in der Zellmembran ebenfalls dorthin
gelangen. An den Stellen, wo der Faltensaum in die "normale"
Zellmembran
übergeht bilden die Zellen eine Kette von örtlich begrenzten
kleinen Kontakten zur Knochenmatrix aus. Ihr
Zytoplasma
ist in den Haftzonen organellenarm, aber reich an Aktinfilamenten
und SRC-Kinase. Über Talin, alpha-Aktinin und Vinculin binden sich
Integrine an die
Aktinfilamenten welche dann
mit ihren extrazellulären Domänen an Osteopontin und Bone-sialoprotein
der Knochenmatrix binden. Durch den hohen
Gehalt an Mitochondrien, die die Energie für
das zur Wasserstoffionengewinnung wichtige Enzym Carboanhydrase 2 liefern,
ist das Zytoplasma der Osteoklasten azidophil.
Die zahlreichen Golgi-Apparate produzieren reichlich
Vesikel, von denen die meisten Lysosomen
sind, die ihren Inhalt über
Exozytose
im Bereich des Resorptionssaums abgeben. Auf diesem Wege gelangen Tartrat-resistente
saure Phosphatase, Beta-Glukoronidase, Arylsulfatase A und Cathepsin K
in die Lakune unterhalb des Resorptionssaums. Auf nicht lysosomalem Wege
werden zusätzlich Prokollagenase, Stromelysin-1 und Lysozym von den
Zellen hierher abgegeben. Mit der Salzsäure gemeinsam bewirken
sie die Zerstörung der Knochenmatrix.
Die dabei ausgelösten Kalziumionen werden über Zellmembrankanäle
in die Osteoklasten aufgenommen und in der Lakune abgewandten Seite wieder
aus den Zellen transportiert. Die Aktivität der Osteoklasten wird
indirekt über Stimulation der benachbarten Osteoblasten
zur Sekretion Osteoklasten stimulierender Faktoren gesteigert, da Osteoklasten
selber keine Parathormonrezeptoren haben. Vitamin D (Calcitriol) stimuliert
die Bildung uns Aktivierung von Osteoklasten. Kalzitonin bremst sie durch
Hemmung der Kalziumkanäle, wodurch das intrazelluläre Kalzium
so steigt, daß es die zur Matrixanhaftung nötigen Aktinfilamente
depolymerisiert. Osteoklasten sind mit den die Knorpelsubstanz abbauenden
Chondroklasten
und den Zahnbein auflösenden Odontoklasten identisch.
Saumzellen (Terminologia histologica:
Cellulae vestientes osseorum, englisch: bone lining cells) sind die im
Endost
aber auch Periost vorkommenden ruhenden Osteoblasten,
die über
Gap-junctions miteinander verbunden
ein flaches Epithel bilden, da zwischen ihnen
praktisch kaum Interzellularsubstanz vorkommt. Diese Zellen haben nur wenig
organellenarmes
Cytoplasma.
Sie ragen mit langen dünnen Fortsätzen in feine Knochenkanälchen
hinein, wo sie mit den Fortsätzen benachbarter Osteozyten
ebenfalls über Gap-junctions verbunden
sind. Erst wenn diese Zellen auseinanderweichen und damit Knochenmatrix
freiliegt, können sich die aus dem Blut
als Makrophagen ausgewanderten monozytären
Vorläuferzellen der Osteoklasten Cadherin-6
vermittelt und nur durch Kontakt mit dem Saumzellen zu Osteoklasten
vereinigen und Knochen angreifen.
Knochengewebsarten:
1. Der Geflechtknochen
(Terminologia histologica: Textus osseus reticulofibrosus; englisch: woven
bone) ist die erste Form von gebildetem Knochen und zeigt sich bei
der desmalen Ossifikation sowie bei
der Entstehung des knöchernen Kallus im Rahmen einer Knochenbruchheilung.
Grundlage ist ein straffes ungeordnetes geflechtartiges Bindegewebsgerüst
an dem sich Kalziumhydroxylapatit und die anderen knochentypischen Matrixsubstanzen
angelagert haben. Ungeordnet treten Hohlräume (Lakunen) mit Osteozyten
auf. Eine lamelläre Ordnung ist nicht erkennbar. Beim Erwachsenen
ist Geflechtknochen nur noch zu finden im massiven Innenbereich des Felsenbeins
(Pars petrosa ossis temporalis) um die Strukturen des Innenohrs (Schnecke
= Cochlea und Gleichgewichtsorgan = Labyrinth)
herum, in den Synostosen (verknöcherten Knochen-Knochen Verbindungen)
z.B. zwischen den Schädelknochen (= Schädelnähte = Suturen)
und ein Stück weit im kompakten Knochengewebe
in Bereichen wo kräftige Bänder an Knochen verankert sind.
2. das spongiöse Knochengewebe
(Terminologia histologica: Textus osseus spongiosus, Textus osseus trabecularis,
englisch: trabecular bone, spongy bone, cancellous bone), welches als schwammartig
löchriges Gerüst aus Knochenbälkchen besteht wird entsprechend
länger einwirkender Druckbelastung stetig auf-, um- und auch abgebaut.
Mit ihren platten- bis säulenförmigen verzweigten Trabekeln (Knochenbälkchen;
Terminologia histologica: Trabeculae osseae, englisch: bone trabecula),
die im Mittel ca. 0,2 bis maximal 0,4 mm dick und bis 0,6 mm lang sind,
sorgt das Gerüst der Spongiosa für die effektive Verteilung
der Druck- und Zugkräfte z.B.: von der Knochenoberfläche
auf die Seitenbereiche, wo sie in die Pars compacta übergeht. Man
spricht in diesem Zusammenhang von einer trajektoriellen Knochenbälkchenarchitektur.
Die Spongiosa macht ca. 20% des gesamten Knochengewebes aus. Die
als Diploë bezeichnete Schicht zwischen innerer und äußerer
Oberfläche der meisten Schädelknochen besteht auch aus spongiösem
Knochengewebe. Die Knochenbälkchen sind aus im Querschnitt etwa halbmondförmigen
Trabekellamellen
aufgebaut. Diese länglich parallel zum Verlauf des Trabekels orientierten
Schichten zeigen nur wenige in Lakunen gelegene
Osteozyten
und sind in Lamellenpaketen organisiert, die durch kollagenfreie Zementlinien
getrennt sind und ehemalige Resorptionslakumen ausfüllen, die durch
den hier stetig stattfindenden
Knochenumbau
entstehen. Selten kommen hier auch einzelne Speziallamellen
um feine ans Endost angeschlossene Zentralkanäle vor. Der überwiegende
Teil der Knochenbälkchen hat jedoch keine eigenen Blutgefäße
und wird durch Diffusion aus dem anliegenden Endost
bzw. dem in ihren Hohlräumen liegenden Knochenmark
ernährt.
3. Das faszikuläre Knochengewebe (Terminologia histologica:
Textus osseus fasciculatus, englisch: bundle bone) bildet dem Übergangsbereich
vom spongiösen Knochengewebe zum
Lamellenknochen
und zeigt größere Bündel noch lamellierten Knochens, die
dann in die so gut wie nicht mehr mit Haversschen Systemen ausgestatteten
Knochenbälkchen der Spongiosa übergehen.
4. Das kompakte Knochengewebe
(Terminologia histologica: Textus osseus compactus, englisch: compact bone)
liegt als massive Knochenmasse an und direkt unter der Oberfläche
von Röhrenknochen und auch als Substantia compacta am
Knochenschaft, bzw. Substantia corticalis an den Knochenenden. Auch
die innere und äußerer Oberfläche der Schädelknochen
(Tabula interna und - externa) wird von der stabilen Substantia corticalis
gebildet. Im Schläfenbein (Os temporale) umgibt das kompakte Knochengewebe
die zu schützenden Strukturen des Innenohrs. Wobei es nur hier als
Geflechtknochen
organisiert ist ansonsten liegt es in Form von
Lamellenknochengewebe (Terminologia
histologica: Textus osseus lamellaris, englisch: lamellar bone) vor. Dieses
besteht aus 2-4 mm starken Knochenlamellen (Terminologia
histologica: Lamellae osseae, englisch: bone lamellas). Dabei wechseln
sich meistens gleichsinnig verlaufende (aniostrope) Kollagenfibrillen
einer Lamelle mit zumeist gegensinnig verlaufenden Kollagenfibrillen
der Nachbarlamelle ab, was man im Polarisationsmikroskop als Muster heller
und dunkler Banden erkennen kann. Die Lamellen sind zumeist in Längsrichtung
des Schafts orientiert. Von Innen nach außen betrachtet finden sich
folgende
Schichten des Lamellenknochens:
A. Endost (Terminologia histologica: Endosteum,
englisch: endosteum)
Das Endost, die innere Knochenhaut bedeckt die innere Oberfläche
der Knochenhartsubstanz inklusive Haversscher Kanäle. Seine Oberfläche
ist beim Erwachsenen insgesamt ca. 15,5m² groß, wobei davon
11m² die Spongiosa, 3,5 m² die Haversschen Kanäle und nur
1 m² die Pars compacta bedeckt. Wichtig für die Knochenreparatur
bei Frakturen sind die Zellen des Endosts. Dabei handelt es sich um einige
wenige mesenchymale Stammzellen,
wenige Osteoprogenitorzellen,
ruhende/aktive Osteoblasten oder ruhende/aktive
Osteoklasten.
Dabei werden die überwiegend vorkommenden ruhenden epithelartig erscheinenden
Osteoblasten auch als endostale Saumzellen
bezeichnet. Das Endost setzt sich in die ins Innere des kompakten Knochengewebes
und oft bis ins Periost weiterziehenden Volkmann'schen
Kanäle fort. Unter dem Endost folgt in Richtung Knochen ein schmaler
Bereich unmineralisierter Matrix (Osteoid).
B. innere Generallamellen
(= innere Zirkumferenzlamellen; Terminologia histologica: Lamellae cricumferentiales
internae, englisch: internal circumferential lamellae)
Diese parallel längs zur Knochenrichtung orientierten riesigen
Lamellen zeigen in Schichten liegende Osteozyten
mit umgebender mineralisierter Matrix und sind etwas schmächtiger
als die äußeren Generallamellen. Die hier gelegenen Osteozyten
senden ihre dünnen Fortsätze zum Endost,
um sich zu ernähren. Die inneren Zirkumferenzlamellen grenzen an die
C. Speziallamellen (= Osteonlamellen;
Terminologia histologica: Lamellae osteoni, englisch: osteon concentric
lamellae) sind um 5 bis zu 30 rundlich um einen
zentralen Kanal
(Haversscher Kanal; Terminologia histologica: Canalis osteoni, Canalis
centralis; englisch: osteonic canal, central canal) konzentrisch ausgebildete
Lamellen aus verkalkter Knochenmatrix mit
Schichten in Lakunen (Terminologia histologica: Lacunae osteocytorum, englisch:
osteocyte lacunae) gelegener Osteozyten dazwischen. Diese sind untereinander
über feine Zellfortsätze über Gap-junctions
verbunden, senden aber auch senkrecht in Richtung des Zentralkanals sowie
entgegengesetzt ebenfalls Fortsätze aus. Dabei bezeichnet man als
funktionelle Grundeinheit des Knochen das Osteon (= Haverssches
System; engl: Haversian system; Terminologia histologica: Osteonum
primarium, englisch: primary osteon). Dieses besteht aus dem zentralen
Kanal und den umgebenden Zellen sowie den zugehörigen Lamellen. Es
hat im Durchschnitt eine Länge von 2,5 mm bei einem
Durchmesser
von 0,2 mm.
In den über Volkmannsche Kanäle
miteinander und nach Innen/Außen verbundenen Zentralkanälen
finden sich zentral eine Kapillare oder
Venole
mit fenestrierten Endothelzellen, dann lockeres
Bindegewebe mit feinen dendritischen nur ausnahmsweise myelinisierten
Nervenendigungen und selten freien Bindegewebszellen
und darauf die Saumzellen des Endost gefolgt
von 5 - 30 konzentrischen Osteozytenlagen. Die lichtmikroskopisch
stark eosinophilen Osteone enden mit einer 1-2 µm dicken kollagenfreien
Zementlinie
(Terminologia histologica: Linea cementalis, englisch: cement line, reversal
line), die sich basophil anfärbt. Sehr dünne (>0,5 µm)
Zementlinien sind öfters auch zwischen einzelnen Lamellen zu erkennen.
Dazwischen liegen Schaltlamellen
(= interstitielle Lamellen; Terminologia histologica: Lamellae interstitiales,
englisch: interstitial lamellae). Diese sind alte teilresorbierte „Lücken
füllende“ Speziallamellen oder Reste teilarrodierter Generallamellen
ohne Havers Kanal. Sie entstehen im Rahmen des Knochenumbaus.
Nach außen folgen
D. äußere Generallamellen (= äußere Zirkumferenzlamellen;
Terminologia histologica: Lamellae cricumferentiales externae, englisch:
external circumferential lamellae) sind zur Knochenoberfläche parallel
längsorientierte riesigen (einigen hundert µm dicke) Lamellen
aus mineralisierter Knochenmatrix mit den
darin in Lakunen liegenden Osteozyten, die sich
vom Periost her ernähren.
E. Periost (Terminologia histologica:
Periosteum, englisch: periosteum)
Das Periost, die äußere Knochenhaut bedeckt die äußere
Oberfläche der Knochenhartsubstanz mit Ausnahme von 1. Anheftungsstellen
von Muskeln, Sehnen
und Bändern, 2. mit hyalinem Knorpel
überzogenen Gelenkflächen, 3. von Synovialmembran überzogenen
Knochenteilen wie der Gelenkinnenhaut wie z.B. am Halsbereich des Oberschenkelknochens
(Collum femoris). Im Periost unterscheidet man die innen direkt am Knochen
gelegene zellreiche Schicht (Terminologia histologica: Stratum osteogenicum,
englisch: osteogenic layer). Die hier gelegenen Zellen sind ebenfalls für
die Reparatur von Frakturen wichtig;
sie gleichen denen des Endosts und sind einige wenige
mesenchymale
Stammzellen, wenige
Osteoprogenitorzellen,
ruhende/aktive
Osteoblasten oder ruhende/aktive
Osteoklasten. Auch hier werden die ruhenden
epithelartig erscheinenden Zellen unter dem Begriff Saumzellen
zusammengefaßt. Unter diesen folgt in Richtung Knochen ein schmaler
Bereich unmineralisierter Matrix solange noch Dickenwachstum erfolgt. Eine
feste Verbindung des Periosts zur Knochensubstanz kommt zustande durch
aus der Knochenmatrix stammende als Sharpeysche
Fasern bezeichnete
Kollagenfasern (Terminologia
histologica: Fasciculi collageni perforantes, englisch: perforating collagen
fibre bundles). Diese setzen sich durch das Stratum osteogenicum hindurch
in die darauffolgende äußere Schicht des Periosts fort, das
Stratum fibrosum (Terminologia histologica: Stratum fibrosum, englisch:
fibrous layer). Letzteres besteht aus straffem
geflechtartigem kollagenen Bindegewebe. Auch die Kollagenfasern
am Knochen befestigter Sehnen und Bänder
ziehen als Sharpey Fasern direkt weiter in die Knochenmatrix hinein, wodurch
an diesen Stellen das Periost unterbrochen wird. In das Periost ziehen
zahlreiche Blutgefäße von denen
sich einige in den Knochen hinein fortsetzen. Die dazu dienenden in der
Regel in etwa senkrecht zur Knochenoberfläche verlaufenden
Kanäle werden als Volkmann Kanäle
(Terminologia histologica: Canales osseorum, englisch: bone canals) bezeichnet,
dabei kann man noch zwischen den bis ins Endost reichenden perforierenden
Kanälen (Terminologia histologica: Canales perforantes, englisch:
perforating canals) und den nur ein Stück weit in die Corticalis
des Knochens ziehenden transversalen Kanälen (Terminologia histologica:
Canales transversi, englisch: transverse canals) unterscheiden. Diese Kanäle
haben im Gegensatz zu den Haversschen Kanälen, die an sie angeschlossen
sind, jedoch KEINE umgebenden Lamellenschichten. Funktionell bezeichnet
man alle zur Ernährung des Knochens beitragenden Kanäle noch
als Ernährungskanäle (Terminologia histologica: Canales nutricii,
Canales nutrientes; englisch: nutrient canals). Alle genannten Kanäle
enthalten Blutgefäße aber auch
feine dendritische Nervenendigungen und werden von Saumzellen
ausgekleidet. Die Schmerzempfindung bei Knochentraumen gehen jedoch ganz
hauptsächlich von den sehr zahlreichen freien Nervenendigungen aus,
die sich im Periost enden.
Knochenmatrix (Terminologia
histologica: Matrix ossea, englisch: bone matrix)
Die unverkalkte Knochenmatrix wird Osteoid
genannt und von den Osteoblasten und -zyten
gebildet. Der Anteil der Knochenmasse an der Gesamtmasse des Körpers
beträgt ca. 5,7% (etwa 4 Kg entsprechend ~1.700 cm³ bei 70 Kg
Körpergewicht). Dabei ist der Wasseranteil mit um die 15 % ganz deutlich
geringer als in anderen Stützgeweben (hyaliner
Knorpel ~70%). Entzieht man der Matrix ihr Wasser so verbleiben ca.
30% organische Substanz und 70% Mineralien (anorganische Substanz). Die
zumeist zu Kollagenfasern (Fibrae collageni; englisch collagen fibres)
gebündelten Kollagenfibrillen
vom Typ 1 machen dabei 90% der organischen Komponente aus. Sie sorgen
für Elastizität und für eine hohe Zugfestigkeit,
daran angelagertes kristallines Kalziumhydoxylapatit 3Ca3(PO4)2
x
Ca(OH)2 (Terminologia histologica: Crystallum hydroxylapatiti,
englisch: hydroxylapatite crystal), welches über 95% der anorganischen
Mineralsubstanz ausmacht, ist Grundlage für die hohe Druckfestigkeit.
Dabei sind jedoch auch wenig weitere eingelagerte oder gebundene Ionen
insbesondere Magnesiumionen (Mg+2), Fluoridionen (F-)
und Carbonationen CO3-, Phosphationen (PO4)-3
und Zitrationen sowie in geringer Menge Kationen von Eisen, Kupfer, Zink,
Strontium und Blei vorhanden. Knochen ist der wichtigste Kalziumspeicher
des Organismus (ca.1 Kg beim Erwachsenen). Neben dem schwer löslichen
Hydroxylapatit liegt Kalzium auch als Carbonat (CaCO3) und als
wegen höherer Wasserlöslichkeit für den schnellen Austausch
besser mobilisierbares Kalziumhydrogenphosphat (CaHPO4) vor.
Die nach dem Kollagen-1 noch verbleibenden
10% der organischen Matrixkomponenten lassen sich weiter untergliedern
in spezielle Matrixproteine (Terminologia histologica: Proteinae
non collagenosae, englisch: noncollagen proteins), Proteoglykane und Glykoproteine.
Zu den Matrixproteinen gehören Kollagen Typ 5 (vernetzt Kollagen Typ
1), Osteocalzin (hemmt die Hydroxylapatit Anlagerung an Kollagen-1), Matrix-GIA-Protein
(Hemmt ebenfalls die Mineralisierung), Metalloproteinase (Kollagenase zur
Kollagenauflösung, Stromelysin degradiert Matrixkomponenten). Zu den
Proteoglykanen
gehören Decorin und Biglykan (regulieren Kollagenfibrillogenese und
hemmen die Mineralisierung) sowie Osteoadherin (fördert Matrixanhaftung
der Osteoblasten und bindet an Hydroxylapatit). Zu den Glykoproteinen
zählen Osteonectin (hemmt Zelladhäsion an der Matrix, hemmt Hydroxylapatit
Kristallbildung), Osteopontin (fördert Integrin-vermittelte Zelladhäsion),
Bone-Sialoprotein (fördert Bildung von Hydroxylapatit Kristallen und
ist in verkalkender Matrix notwendig), Fibronectin (fördert Zelladhäsion
an Matrixkomponenten) und Thrombospondin (stimuliert Zellproliferation
durch Hemmung der Adhäsion). Außerdem ist in der Knochenmatrix
noch Serumalbumin vorhanden und eine Reihe weniger häufiger Komponenten.
Die Mineralisation des Knochens erfolgt, wenn Kalziumhydrogenphosphatkristalle
(CaHPO4) durch Überschreitung des Löslichkeitsprodukts
der beteiligten Ionen (Ca+2, PO4-3, HPO4-2
und H2PO4- ) entstehen, sich über
verschiedene Zwischenstufen in Kalziumhydroxylapatit umwandeln und
schließlich an Kollagenfasern im Osteoid
anlagern. Das Produkt der beteiligten Ionen ist in der Extrazellularflüssigkeit
jedoch für spontane Kristallbildung zu niedrig, so daß die Osteoblasten
helfen müssen. Die alkalische Phosphatase in ihrer und der Zellmembran
der Osteozyten konzentriert sich an feinen Zellfortsätzen, die durch
die Abschnürung von kleinen Zellmembranumhüllter
Zytoplasmabläschen kleine sogenannte Matrixvesikel (Terminologia
histologica: Vesicula matricalis; englisch: matrix vesicle) abschnüren.
In deren Innerem kommt es unter Beteiligung organischer kalziumbindender
Proteine (Calbindin-D, Phosphatidylserin) zu einer ausreichenden Anreicherung
der Ionen, die dann zur Kristallbildung führt. Die wachsenden
Kristalle führen zum Platzen der Membranvesikel. Die nun freien
Kristalle wachsen weiter und lagern sich den 40-nm- Lücken von Kollagenfibrillen
an. Dies geschieht bevorzugt an der Kalzifikationslinie (Terminologia histologica:
Linea calcificationis; englisch: calcification front) des Osteoids. Osteocalzin
und Matrix-GLA-Protein verhindern eine übermäßige Mineralisierung.
Bei Vitamin D3 Mangel kommt es zu Rachitis, die mit einer verminderten
Mineralisierung und dadurch bedingte Instabilität der Knochen einhergeht,
dabei kommt es zu kompensatorischer erhöhter Osteoidbildung
mit Gelenk- und Knochendeformation.
Knochenbildung (Terminologia
histologica: Osteogenesis, englisch: osteogenesis)
A. desmale Ossifikation
(Geflechtknochenbildung; Terminologia histologica: Ossificatio membranacea,
Ossificatio desmalis; englisch: Membranous ossification, intermembranous
ossification)
Bei der desmalen oder membranären Verknöcherung fangen osteogene
Mesenchymverdichtungenab
der 6. Embryonalwoche an Knochengewebe zu bilden, imdem sich
Mesenchymzellen zu Osteoblasten
differenzieren und um sich herum Osteoid ausscheiden,
wodurch sie sich zunehmend einmauern und zu Osteozyten werden. Später
erfolgt die Mineralisation. Über ihre mitwachsenden Fortsätze
bleiben die in den Lakunen liegenden eingemauerten Osteozyten mit dem den
jungen Knochen umgebenden
Mesenchymgewebe
in Verbindung. Es entstehen im Areal eines zu bildenen Knochens unzählige
kleine primäre Trabekel aus Geflechtknochen.
Außen an der Knocheninsel lagern sich epithelartig dicht Osteoblasten
an und sorgen durch ständige Osteoidabscheidung
für schnelle Größenzunahme, dabei werden immer wieder einige
von Ihnen als neue Osteozyten eingemauert. Während durch dieses appositionelle
Wachstum (= Anlagerung von Außen) die Lücken zwischen den Knochenbildungsinseln
allmählich immer kleiner werden, beginnt die Ablagerung von Knochenlamellen
an den primären aus den Knocheninseln gebildeten Spongiosatrabekeln.
Die Zahl der Osteoklasten nimmt stark zu, wodurch
Löcher in den primär gebildeten Geflechtknochen gefressen werden.
Diese werden dann durch neu gebildeten Lamellenknochen (sekundäre
Osteone; Terminologia histologica: Osteona secundaria; englisch: secondary
osteons) ersetzt bis schließlich gar kein Geflechtknochen mehr übrig
bleibt. Zusätzlich entstehen neue primäre Osteone (Terminologia
histologica: Osteona primaria; englisch: primary osteons) um Blutgefäße
der noch zwischen den Blutgefäßen verbliebenen Hohlräume.
Diese verwachsen ohne Ausbildung von Zementlinien mit dem umgebenden Knochen.
Viele davon werden später von Osteoklasten
wieder abgebaut und dabei durch neu gebildete sekundäre osteone ersetzt.
Das Größenwachstum der desmal entstandenen Knochen findet ausschließlich
appositionell statt, d.h. durch Anlagerung neuer Knochensubstanz an die
äußere Oberfläche der schon vorhandenen Hartsubstanz.
Zu den Geflechtknochen, die auch
Deck- Beleg- oder Bindegewebeknochen (Terminologia histologica: Ossa membranacea;
englisch: membranous bones) genannt werden, zählen der Unterkieferknochen
(Mandibula), die Schlüsselbeinschäfte (Corpus claviculae)
und folgende Schädelknochen: Stirnbein (Os frontale), Scheitelbein
(Os parietale), Hinterhauptsbein (Os occipitale), Oberkieferknochen (Maxilla)
und die Schläfenbeinschuppe (Squama ossis temporalis). Alle übrigen
Knochen sind Ersatzknochen. Auch der Vorgang der perichondralen
Ossifikation ist eine desmale Knochenbildung.
B. chondrale Ossifikation
(Ersatzknochenbildung, cartilaginäre Ossifikation, indirekte Ossifikation;
Terminologia histologica: Ossificatio chondralis; englisch: chondral ossification,
cartilaginous ossification)
Alle Knochen, die keine Geflechtknochen
sind, entstehen auf diese Weise und werden enchondrale Knochen genannt
(Terminologia histologica: Ossa endochondralia; englisch: endochondral
bones). Zunächst entstehen im Bereich verdichteter
Mesenchymzellen
Blasteme von hyalinem Knorpel wobei die
Mesenchymzellen
zu Chondroblasten werden, die sich
durch Ausscheidung der Knorpelmatrix in nicht mehr teilungsfähige
Chrondozyten
umwandeln. Bis zu diesem Zeitpunkt findet ein interstitielles Knorpelwachstum
statt. Danach erfolgt die Größenzunahme der zu verknöchernden
Knorpelareale nur noch durch appositionelles Wachstum, d.h. durch Anlagerung
neuer Zellen und neuer Matrix vom Stratum chondrogenicum des Perichondriums
aus. Der entstandene
hyaline Knorpel wandelt
sich dann im Rahmen der enchondralen Ossifikation (Terminologia
histologica: Ossificatio endochondralis; englisch: endochondral ossification)
in Knochengewebe um. Dabei kommt es zum Längenwachstum des zu bildenden
Knochens.
Im Diaphysenbereich
von Röhrenknochen beginnt ab der 7. Embryonalwoche
an Oberschenkelknochen (Femur) und Oberarmknochen (Humerus) eine desmale
Bildung einer Knochenmanschette (Terminologia histologica: Anulus osseus
perichondralis; englisch: perichondral bone anulus) aus osteogenen Zellen
des Perichondriums. Dabei
werden bipotente Progenitorzellen
zu Osteoblasten, die außen Knochensubstanz
anlagern, wobei einige "eingemauert" und zu Osteozyten
werden. Diesen hauptsächlich für das Dickenwachstum von Knochen
wesentlichen Prozess der Auflagerung von Knochensubstanz auf das Perichondrium
nennt man perichondrale Ossifikation (Terminologia histologica:
Ossificatio perichondralis; englisch: perichondral ossification).
Unter der Manschette gelegene Knorpelzellen im Zentrum der knorpeligen
Knochenanlage vergrößern sich (hypertrophieren) wobei hypertrophischer
Knorpel entsteht. Die von diesen Zellen gebildete Grundsubstanz
beginnt zu Verkalken (zentrale Verkalkungsherde). Die hypertrophen Knorpelzellen
(Terminologia histologica: Chondrocyti hypertrophici; englisch: hypertrophic
chondrocytes) scheiden vaskulären endothelialen Wachstumsfaktor (englisch:
vasular endothelial growth factor, VEGF) aus, wodurch es zum Einwachsen
von Kapillaren durch die noch dünne
Knochenmanschette hindurch bis ins Verkalkungszentrum kommt. Dabei fressen
Osteoklasten,
die ja mit
Chondroklasten identisch
sind, sich durch Knochen und Knorpel vor.
Den Kapillaren folgende Mesenchymzellen,
die sich zu Osteoblasten und später auch
zu fibroblastischen Retikulumzellen
(für die Knochenmarkbildung wichtig) differenzieren.
Zusätzlich verschmelzen hier aus dem Blut
austretende Monozyten zu weiteren Osteoklasten.
Die Osteoblasten bilden in den durch die Osteoklasten
geschaffenen Hohlräumen spöngiöse Knochenmatrix, wodurch
ein primäres Ossifikationszentrum (Terminologia histologica:
Centrum ossificationis primarium; Centrum ossificationis diaphysiale; englisch:
primary ossification centre, diaphysial ossification centre) sichtbar wird.
Solange es sich dabei noch um einen kleinen kugelförmigen Bereich
handelt, spricht man von primären Knochenkern (Terminologia
histologica: Gemma osteogenica primaria; englisch: primary osteogenic nucleus).
In schon ein paar Tagen hat der Geflechtknochen
der primären Spongiosa die gesamte Diaphysenanlage ausgefüllt
und in seinen Zwischenräumen, der primären Knochenmarkshöhle
(Terminologia histologica: Cavitas medullaris primaria; englisch: primary
medullary cavity) siedelt sich blutbildendes Knochenmark
an. Durch weiteren Knochenanbau von Außen (appositionelles Wachstum)
bei Resorption im Inneren nimmt die Knochendicke allmählich zu.
Im Bereich der Epiphysen und Metaphysen
findet sich noch hyaliner Knorpel. Das Längenwachstum
findet in der zwischen Epi- und Diaphyse
gelegenen Metaphyse durch interstitielles Wachstum,
also Zellteilung und dadurch Vermehrung der
Chondroblasten
statt. Dieser Wachstumsbereich wird als Epiphysenfuge bezeichnet, das hier
gelegene wachsende Knorpelgewebe als Epiphysenknorpel (Terminologia histologica:
Cartilago epiphysialis; englisch: epiphysial cartilage). Erst nach der
Geburt findet in diesem Bereich erste Knochenbildung durch die eigentliche
enchondrale
Ossifikation statt und erst mit dem endgültigen Abschluß
des Körperwachstums im Erwachsenenalter wird auch in diesem Bereich
eine vollständige Verknöcherung erreicht sein.
Man unterscheidet folgende 6 Zonen
im Bereich der Epiphysenfuge; Terminologia histologica: Centrum
ossificationis secundarium, Centrum ossificationis epiphysiale; englisch:
secondary ossification centre, epiphysial ossification centre) von der
Epiphyse
in Richtung Diaphyse betrachtet:
1. Die Reservezone (Terminologia histologica: Zona quiescens;
englisch: resting zone, quiescent zone) befindet sich zwischen der Epiphyse
und der Epiphysenfuge und zeigt zumeist einzeln liegende Chrondozyten/Chondroblasten
in
hyalinem Knorpel.
2. Die Proliferationszone (Terminologia histologica: Zona proliferationis;
englisch: proliferation zone) zeigt eine sehr hohe Teilungsaktivität
der Chondroblasten und ist der wesentliche
Bereich für das überwiegend in Längsrichtung des Knochens
stattfindende Wachstum. Dabei werden Epiphyse und
Diaphyse
allmählich immer weiter auseinander geschoben. Die Zellen erscheinen
in der Proliferationszone zumeist platt übereinandergestapelt, weshalb
man auch vom Säulenknorpel spricht. Man erkennt viele parallel zueinander
stehende Zellsäulen (Terminologia histologica: Columnellae chondrocytorum;
englisch: chondrocyte columns), die durch nur wenig interterritoriale
Matrix getrennt sind. Als Maturationszone (Reifungszone) wird
zuweilen auch noch der Übergangsbereich der Proliferations- zur Hypertrophiezone
bezeichnet. Hier zeigt sich schon erste vermehrte Glykogeneinlagerung
ins Zytoplasma der Chrondozyten.
3. Die Hypertrophiezone (Terminologia histologica: Zona hypertrophica;
englisch: hypertrophic zone) mit sehr stoffwechselaktiven hypertrophen
Knorpelzellen (Terminologia histologica: Chondrocyti hypertrophici; englisch:
hypertrophic chondrocytes), die besonders an Dicke zunehmen und vermehrt
Glykogen
einlagern. Die Zellen geben PDGF (platelet derived growth factor) ab, was
Einwanderung und Wachstum von Osteoblasten
fördert. Sie produzieren
Kollagen 10,
welches ein feines Netzwerk um die Zellen herum ausbildet und Matrix-GIA-Protein
welches einer zu starken Verkalkung entgegenwirkt. Fixierungsbedingt
erscheinen die hypertrophen Knorpelzellen in lichtmikroskopischen Präparaten
oft blasig aufgetrieben, weshalb sie auch als Blasenknorpelzellen
(Terminologia histologica: Chondrocyti hypertrophici; englisch: hypertrophic
chondrocytes) bezeichnet werden.
4. Die Verkalkungszone (Terminologia histologica: Zona calcificationis;
englisch: calcification zone) zeigt eine Kalkeinlagerung in der
interterritorialen
Matrix
zwischen den Zellsäulen, so daß hier kalzifizierter Knorpel
(Terminologia histologica: Cartilago calcificata; englisch: calcified cartilage)
entsteht. Zwischen den aufgereihten Zellen selbst kommt es nicht zur Kalkeinlagerung,
sondern zur Auflösung der Matrix.
5. Die Resorptionszone (Eröffnungszone; Terminologia histologica:
Zona erosionis; englisch: erosion zone) zeigt das Resultat davon, die Chrondozyten
liegen nun direkt aneinander in parallel zueinander stehenden tunnelförmigen
Höhlen (Terminologia histologica: Cavitates cartilaginis; englisch:
cartilaginous lacunae), deren Wände kalzifizierte Knorpelsepten (Terminologia
histologica: Trabeculae cartilagineae; englisch: cartilaginous trabeculae)
sind. Die Chrondozyten zeigen erste
Zeichen des programmierten Zelltods (Apoptose).
6. Die Verknöcherungszone (Terminologia histologica: Zona
ossificationis; englisch: ossification zone) beginnt dort, wo die letzten
Chrondozyten
durch Apoptose abgestorben sind. Die verbliebenen länglichen
Hohlräume werden als Erosionslakunen (Terminologia histologica: Lacunae
erosionis; englisch: erosion lacunae) bezeichnet. Zum Teil werden sie durch
Chondroklasten
noch etwas erweitert, die von unten her aus der primären Knochenmarkhöhle
hierher gelangen. Die verbleibenden Kalkknorpelsepten werden von mit Kapillaren
aus der Knochenmarkhöhle vorwandernden
Osteoblasten
bald mit einer dünnen Lage
Geflechtknochen
überzogen. Man bezeichnet dies nun als primären Knochenbälkchen
(Terminologia histologica: Trabeculae osseae primariae; englisch: primary
bone trabeculae). Lichtmikroskopisch lassen sich in der Verknöcherungszone
daher neben der basophilen Kalkknorpelmatrix dünne azidophile Bereiche
jungen Knochens erkennen, der als endochondraler Knochen (Terminologia
histologica: Textus osseus endochondralis; englisch: endochondral bone)
bezeichnet wird. Etwas weiter unten in Richtung Knochenmarkhöhle
finden sich viele Osteoklasten, die die Enden
der eben erwähnten Knochenbälkchen wieder auflösen und so
Platz für die stetig wachsende Markhöhle schaffen. Nur am Seitenbereich
unterhalb der Epiphysenfuge kommt es zur Bildung primärer Osteone
entlang von
Kapillaren aus der Markhöhle,
da hier ja die Korticalis der Diaphyse im Sinne des Knochenlängenwachstums
fortgeführt werden muß. Diese neuen Osteone können später
zu sekundären Knochentrabekeln (Terminologia histologica:
Trabeculae osseae secundariae; englisch: secondary bone trabeculae) umgebaut
werden.
sekundäre Ossifikation: Vor ihrem endgültigen Verknöchern
zeigen sich in der Epiphysenfuge sekundäre Knochenkerne (Terminologia
histologica: Gemmae osteogenicae secundariae; englisch: secondary osteogenic
nuclei), die restlichen Chrondozyten
hypertrophieren zu Blasenknorpelzellen, bilden Kalkknorpel (Terminologia
histologica: Cartilago calcificata, englisch: calcified cartilage) um dann
schließlich abzusterben. Einwandernde Chondroklasten
räumen das verbliebene Knorpelgewebe ab und begleitende Osteoblasten
bilden letztlich Knochen in dem nun als Epiphysenlinie (Linea epiphysialis)
bezeichneten Bereich. Nur in der gelenknahen Region bleibt der Epiphysenknorpel
zeitlebens als hyaliner Gelenkknorpel erhalten.
Nach der Geburt schon zeigen sich in einigen Knochen im mittleren Bereich
der Epiphysen sekundäre Ossifikationszentren
(Terminologia histologica: Centrae ossificationes secundariae, Centrae
ossificationes epiphysialiae; englisch: secondary ossification centres,
epiphysial ossification centres). Zuerst findet man sie in der distalen
Femur- und proximalen Tibiaepiphyse (untere Oberschenkelknochen- und obere
Schienbeinepiphyse). Anhand des Auftretens der in Röntgenaufnahmen
erkennbaren Knochenkerne kann man relativ genau das Alter
eines Kindes bestimmen, da dies nach einem genetisch allgemein vorgegebenen
starren Zeitplan erfolgt.
Auch platte, kurze und irreguläre Knochen verknöchern prinzipiell
nach dem hier beschriebenen Schema, bisweilen gibt es den Epiphysenfugen
analoge Knorpelfugen für Längenwachstum während Breitenwachstum
stets appositionell erfolgt.
Knochenumbau
Da Knochen lebt, finden hier den mechanischen Erfordernissen folgend
stetig
Umbauvorgänge statt. In der Spongiosa
werden so ca. 28% in der Kompakta ca.
4% der Matrix im Jahr erneuert. Normalerweise
stellt sich ein Gleichgewicht zwischen Auf- und Abbau ein. Überwiegen
Abbauvorgänge so kommt es zur Osteoporose, überwiegt Aufbau zur
Osteopetrose. Wenn
Osteoklasten im Rahmen des
Knochenumbaus mit einer Geschwindigkeit von bis zu 40 µm pro Tag
in die Hartsubstanz des Knochen vorwachsen, fressen Sie Hohlräume
entweder als Resorptionslakunen (Howship-Lakunen; Terminologia histologica:
Cavitates resorptionis; englisch: resorption cavities) im spongiösen
Knochen oder Ersosionkanäle (Terminologia histologica: Canales
erosiones, englisch: erosion canals) im kompakten
Knochengewebe. Die rundliche Form der schalenförmigen um 60 µm
tiefen, ca. 100 µn breiten Resorptionslakunen ist der Grund
für die gebogene Lamellenstruktur der Trabekel im spongiösen
Knochen. Im kompakten Knochengewebe
haben die Ersosionkanäle Durchmesser von ca. 200 µm und
sind mehrere Millimeter lang. An ihrer Spitze bildet sich eine kegelförmige
Erosionslinie
(Terminologia histologica: Linea erosionis, Linea resorptionis; englisch:
erosion front) aus nebeneinander gelegenen Osteoklasten
aus, dahinter folgt innen eine Kapillare,
die von spärlich Bindegewebe
begleitet ist, und außen eine monozytäre Umkehrzone mit
aus Monozyten entstandenen Makrophagen,
die die entkalkte Matrix beseitigen. Die anschließende osteoblastäre
Verschlußzone zeigt sehr viele Osteoblasten,
die durch Bildung neuer Knochenlamellen den Defekt wieder verschließen.
Wenn nach mehreren Wochen die Osteoklasten
an der Tunnelspitze ihre Aktivität einstellen (wahrscheinlich wenn
Sie auf in Havers- oder Volkmann
Kanälen gelegenes Bindegewebe
stoßen) schließt sich der Defekt, die Osteoblasten,
die im Zuge der Erneuerung nicht eingemauert wurden werden zu Saumzellen
und die neue Speziallamelle ist fertig.
Knochenbruchheilung
Bei der Knochenbruchheilung im Rahmen von Verletzungen werden die ruhenden
Saumzellen
im Stratum osteogenicum von End- und Periost
stimuliert und proliferieren. Eine primäre Frakturheilung ist
möglich, wenn das Periost nicht zerreißt
und der Bruchspalt unter 1 mm weit ist. Dann findet eine Kontaktheilung
statt bei der Speziallamellen von beiden
Seiten über den Spalt hinweg wachsen und schon nach ca. 3 Wochen der
Knochen wieder funktionsfähig hergestellt ist. Bei Frakturspalten
um 1 mm kommt es zur Spaltheilung, dabei wächst nur sehr wenig kapillarreiches
Bindegewebe
in den Spalt, nahe Osteoprogenitorzellen und Saumzellen werden aktiviert
und schon bald bildet sich um die Kapillaren
ein Verknöcherungsmantel. Meistens kommt es jedoch zur sekundären
Frakturheilung bei der größere Bruchspalten mit Dislokation
der Bruchenden eintritt. Es kommt zur Einblutung und Hämatombildung.
An den mangels Blutversorgung absterbenden Knochenenden siedeln sich Osteoklasten
an, die die Matrix soweit abräumen bis sie auf "überlebende Zellen
stoßen. Fibroblasten, Kapillaren
und osteogene Zellen wandern in das Hämatom ein, welches durch Makrophagen
abgeräumt wird. In ca. 1 Woche hat sich ein Bindegewebskallus
aus faserreichem Narbengewebe
gebildet. Da dabei auch die Vorläuferzellen sich schnell differenzieren
entstehen neben Osteoblasten auch Chondroblasten
und zunächst wird ein knöchern-hyalinknorpeliges Ersatzgewebe
gebildet, der provisorische Kallus. Im Laufe von Wochen bis Monaten
wandelt sich dieser dann vollständig in Lamellenknochen
um (Lamellenknochenkallus), wenn durch Ruhigstellung keine Verschiebebewegungen
an der Bruchstelle auftreten. Erfolgt keine ausreichende Ruhigstellung
bleibt der Knorpelgewebsanteil erhalten und es wird auch langfristig keine
Stabilität erreicht.
--> hyaliner-, elastischer
Knorpel, Bindegewebe, ortsständige
Bindegewebszellen, Knochenmark
--> Elektronenmikroskopischer Atlas Gesamtübersicht
--> Homepage des Workshops
Die meisten Bilder wurden von Prof. H. Wartenberg
zur Verfügung gestellt; übrige Aufnahmen, Seite & Copyright
H. Jastrow.

















