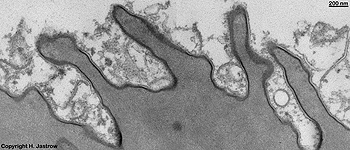
Miniaturbildübersicht Zellmembran
(Membrana cellularis):
Bereits bezeichnete Abbildungen lassen sich
durch Anklicken des Textes aufrufen!
 |

|
 |
 |
 |
 |
 |
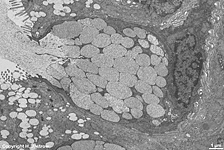
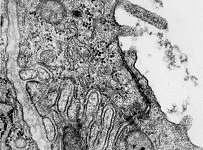
2 Zellmembranen und Inter-
zellularraum (Ratte) |
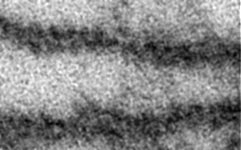
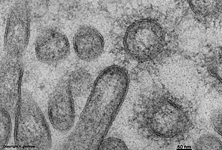
Zellmembran eines Ery-
throcyten (Gefrierbruch, Mensch) |
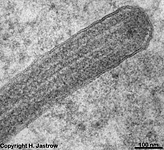
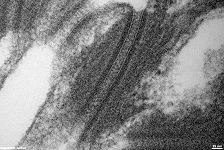
Zellmembranstapel im
Stäbchenaußenglied (Ratte) |
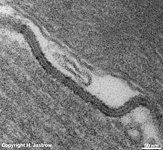
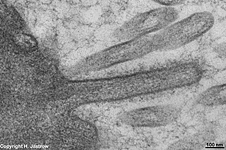
Zellmembranein-
stülpung (Ratte) |
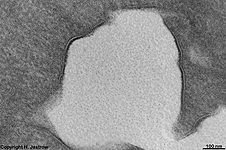
verdickte Zellmem-
bran der Harnbalse (Ratte) |
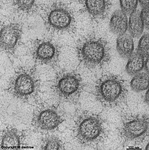
Erythrocyt
Zellmembran (Ratte) |
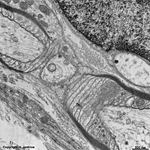
enge Verbindungen der Zellmem-
branen mit Bildung von Kanälen
bei elektrischen Synapsen (Ratte) |
|
 |
 |
 |
 |
 |
 |
Die Zellmembran an einem
Kinocilium (Mensch) |
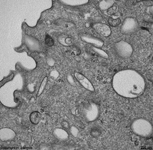
Mikrovilli längs und quer mit Glyko-
kalix auf der Zellmembran (Mensch) |
Zellmembranausstülpung
als Mikrovillus (Mensch) |
Mikrovilli im Quer-
schnitt (Mensch) |
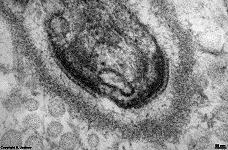
Digitationen = verzahnte
Zellmembranen (Ratte) |
Myelinscheide aus vielen Wick-
lungen der Zellmembran (Ratte) |
Zellmembran am Ranvier
Schnürring (Mensch) |
|

|

|
|
|

|
|
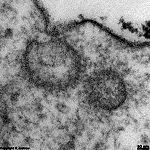
Ureter: Bildung von
Membranvesikeln (Schwein) |
Solche Vesikel einer
Deckzelle (Schwein) |
unregelmäßige Oberfläche
Deckzelle (Schwein) |
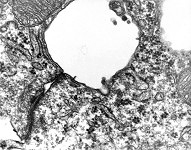
Plaque angeheftet an die Zellmembran
in einem Halbdesmosom (Ratte) |
stabile Verbindung von Zellen
über Kontakte durch die Membran:
Desmosom menschlicher Haut |
Membranvesikelbildung
Ureter (Schwein) |
Detail: verdickte Außenlamelle
der Zellmembran Ureter (Schwein) |
Die Zellmembran (Terminologia histologica: Plasmalemma;
Membrana cellularis, englisch: plasmalemma; cell membrane) wird
auch als Plasmamembran, Plasmalemm oder Cytomembran bezeichnet und ist
eine Bioeinheitsmembran, also eine Doppelmembran.
Sie bildet die äußere Begrenzung aller menschlichen
und tierischen Zellen. Sie grenzt damit
das Zellinnere, also den mit Cytoplasma
gefüllten Zelleib oder Intrazellularraum vom außerhalb gelegenen
Extrazellularraum ab. Im Lichtmikroskop ist die Zellmembran nicht erkennbar,
da sie nur 6 bis 9 (meist 8) nm, dick ist. Trotzdem ist dieses dünne
elastisch verformbare Häutchen ziemlich stabil.
Biochemischer Aufbau:
Als Bioeinheitsmembran besteht die Zellmembran aus Lipiden und Proteinen,
die auch als Glykolipide oder Glykoproteine an der Membranoberfläche
mit Zuckern verknüpft sein können, die dort die Glykokalix
bilden. Das Verhältnis von Lipiden zu Proteinen beträgt 4 zu
1 bis 1 zu 4 und ist abhängig von der Art und Stoffwechselaktivität
der zugehörigen Zelle. Die meisten der am Aufbau der Zellmembran beteiligten
Lipide
sind Phospholipide, die man in Glycerophosphatide (Phosphatidyläthanolamin,
Phosphatidylcholin, Phosphatidylserin) und
Sphingophosphatide (Sphingomyelin,
Cerebroside, Ganglioside) unterteilt. Daneben findet sich auch Cholesterin
als neutrales Lipid. Während nur die äußere Seite der Zellmembran
Glykoproteine und Glykolipide und ansonsten eher Sphingomyelin und Phosphatidylcholin
enthält, weist die Innenmembran relativ mehr Phosphatidyläthanolamin
auf; Phosphatidylserin kommt nur in der inneren Schicht vor. Die meisten
der Lipide der Zellmembran besitzen einen polaren Kopfteil
der hydrophil, also wasser"anziehend" und damit fettabstoßend
(lipophob) ist. Ihr aus 2 langen Fettsäureketten (oft ist eine davon
ungesättigt) bestehender
Schwanzteil ist apolar, also wasser"abstoßend"
und damit fettanziehend (lipophil). Damit ist ein solches Lipid
amphipathisch, d.h. es hat an seinen beiden Molekülenden entgegengesetzte
Eigenschaften. Gelangt eine größere Zahl solcher Moleküle
in ein wäßriges Medium, wie es im Körper vorhanden ist,
ordnen sie sich spontan in rundlichen Gebilden an. Dabei handelt es sich
zum einen um Mizellen zum anderen um Liposomen. Mizellen sind kugelförmige
Ansammlungen der amphipathischen Lipide in denen die hydrophilen Kopfteile
außen und die Schwanzteile innen liegen. Die ebenfalls rundlichen
Liposomen
bestehen aus einer Doppelmembran, die etwas Flüssigkeit umschließt
und sind folgendermaßen aufgebaut: außen liegen die hydrophilen
Kopfbereiche der Moleküle nebeneinander, in der Mitte der Membran
stoßen die langen Schwanzteile einer zweiten Schicht der Moleküle
aneinander, die zum Innenraum der Mizelle hin umgekehrt orientiert liegen
und damit wieder ihre hydrophilen Kopfteile zum wäßrigen Medium
(des Innenraums) ausrichten;
schematisch: außen - Kopf
Lipid 1 - Schwanz Lipid 1 - Schwanz
Lipid 2 - Kopf Lipid 2 - Innenraum
der Mizelle.
Letztlich ist dies auch der Aufbau der Zellmembran, wobei hier zusätzlich
noch viele unterschiedliche Eiweißstoffe (Proteine) eingebaut
sind. Man unterscheidet bei diesen Proteinen periphere und integrale. Die
peripheren
Proteine sind elektrostatisch außen an die polaren Kopfteile der
Lipide gebunden, können also auf der äußeren oder der cytoplasmatischen
Seite der Membran liegen. Die integralen Proteine reichen mit einem hydrophoben
Molekülabschnitt in das hydrophobe Zentrum der Membran hinein. Handelt
es sich um große Proteine, so können sie bei entsprechendem
Aufbau auf Innen- und Außenseite der Membran sichtbar werden; solche
Proteine bezeichnet man als Transmembranproteine. Oft sind diese
Proteine so gebaut, daß sie in ihrem Inneren einen feinen Kanal bilden,
der den Ein- bzw. Austritt von Ionen und kleinen Molekülen sowie Wasser
ermöglicht. Man spricht dann von Tunnelproteinen. Als
Ionenkanäle
sind sie besonders wichtig für die Erregungsbildung und -leitung.
Die Öffnung und das Schließen aller Tunnelproteine geht mit
einer dreidimensionalen Strukturveränderung dieser Eiweißstoffe
einher, die den in der Regel sehr spezifischen Transport ihres Substrates
ermöglicht. Die Bindung des zu transportierenden Stoffes an einen
spezifischen Abschnitt des Proteins kann hierfür schon ausreichen.
Oft ist jedoch noch ein zusätzliches Signal, die Bindung von extra-
oder intrazellulären Botenstoffen notwendig.
Alle Bestandteile der Zellmembran sind in dieser frei beweglich
und können sich gegeneinander verschieben, weshalb man auch vom "fluid
mosaic membrane model" spricht. Dabei nimmt die Beweglichkeit mit der
Temperatur zu. Bei niedrigen Temperaturen ist die Zellmembran dünner
(6 nm) und hat eine gel-artige Konsistenz, bei höheren
Temperaturen kann ihre Dicke bis 9 nm zunehmen und die Konsistenz
wird sol-artig. Bei Körpertemperatur ist die Zellmembran
ca. 8 nm dick und solartig.
Elektronenmikroskopischer Aufbau:
Elektronenmikroskopisch ist die Zellmembran aus 3 Schichten
aufgebaut:
- außen also an der äußeren
Oberfläche (Terminologia histologica: Facies externa; englisch: outer
surface; superficial surface) ein 2,5 nm dicker elektronendichter
Bereich (Terminologia histologica: Lamina densa externa; englisch: external
dense lamina), in dem sich die hydrophilen Bereiche der Lipide eingelagerte
sowie direkt anliegende Proteine finden. An manchen Zellen ist an den in
Richtung Extrazellularraum ragenden Membranproteinen zusätzlich eine
aus Zuckern bestehende Glykokalix
(Terminologia histologica: Glycocalyx; englisch: glycocalyx) verankert.
Bei Präparaten, die mit der Gefrierbruchtechnik hergestellt wurden
(in tiefgefrorenem Zustand wird das Präparat mit entsprechenden Apparaten
in Teile zerbrochen) wird die äußere Fläche der Zellmembran
als E-Fläche bezeichnet (Terminologia histologica: Facies E; Facies
fracta externa; englisch: E face; external fractured face; exoplasmic face).
- in der Mitte ein 3 nm starker heller
Bereich (Terminologia histologica: Lamina intermedia lucida; englisch:
middle lucent lamina), wo die hydrophoben Enden der Lipide und Transmembranproteine
mit ihrer hydrphoben Region liegen; selten finden sich in diesem Bereich
feine elektronendichte Körnchen (Terminologia histologica: Granula
intramembranacea; englisch: intramembrane particles), Vorwölbungen
(Terminologia histologica: Protrusiones granulorum intramembranaceorum;
englisch: protrusion of intramembrane particles), seltener Einziehungen
(Terminologia histologica: Impressiones granulorum intramembranaceorm;
englisch: impression of intramembrane particles) der gesamten Membran verursachen.
- innen also an der zum Zellinneren gewandten
Fläche (Terminologia histologica: Facies interna; englisch: inner
surface; cytosolic face) zeigt die Zellmembran einen 2,5 nm breiten
elektronendichten
Bereich (Terminologia histologica: Lamina densa interna; englisch: internal
dense lamina). An den hier gelegenen Proteinen der Innenschicht sind Cytoskelettfilamente
verankert. Bei Präparaten, die mit der Gefrierbruchtechnik erzeugt
wurden wird die innere Fläche der Zellmembran als P-Fläche bezeichnet
(Terminologia histologica: Facies P; Facies fracta cytoplasmica; Facies
fracta protoplasmica; englisch: protoplasmic fractured face; P face).
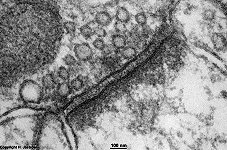
Eine Abbildung oben zeigt ein mit Gefrierbruchtechnik hergestelltes
Präparat. Die Doppelmembranen werden hiebei in dem Bereich, wo die
Schwanzteile der Lipide aneinander stoßen, aufgebrochen und es zeigt
sich die äußere Bruchfläche (exoplasmische = E-Fläche)
und die innere (protoplasmische = P-Fläche). Mit Hilfe dieser Technik
kann man die zerbrochenen Transmembranproteine von den einheitlichen feinen
Strukturen der Lipidmolekülschwanzenden unterscheiden.
Funktion
- Die Zellmembran wirkt als Grenzschicht und trennt das extrazelluläre
Milieu vom intrazellulären. Alle Stoffe, die in die Zelle hinein oder
aus ihr heraus transportiert werden, müssen sie passieren. Die Zellmembran
ist semipermeabel, d.h. nur für bestimmte Stoffe durchlässig:
kleine lipophile Moleküle wie z.B. Steroidhormone und Schilddrüsenhormone
können die Zellmembran direkt passieren, alle größeren
oder hydrophilen Substanzen müssen über proteinvermittelte Mechanismen
in der Regel unter Energieverbrauch transportiert werden.
- Die Form der Zellmembran paßt sich allen Formveränderungen
der Zelle plastisch an, z.B. beim Ausbilden und Einziehen von Fortsätzen
(Pseudopodien) frei beweglicher Zellen.
Dabei kann in Vesikeln verpackte Zellmembran
von einer Seite zur anderen verschoben werden.
- elektrische Erregungen von Zellen breiten sich über die Zellmembran
aus, was bei der Reizleitung von Nervenzellen und deren Fortsätzen
wichtig ist.
- Die an der äußeren Membranoberfläche vieler Zellen
befindliche
Glykokalix ist sehr
wichtig für Blutgruppeneigenschaften und
die Zellerkennung durch das Immunsystem.
- Die innere Membranoberfläche besitzt integrale Proteine, die
der Befestigung des Cytoskeletts und damit
der Stabilität der gesamten Zelle dienen.
- Die Funktion von Zellen wird durch extrazelluläre Signale gesteuert,
die zum großen Teil an Rezeptoren der Zellmembran empfangen
werden.
Die meisten der membrangebundenen Proteine wirken als Rezeptoren
(Bindungsorte) für bestimmte Substrate (Rezeptormoleküle = Liganten)
und sind in der Regel sehr spezifisch, d.h. an ihren Bindungsstellen
können nur Stoffe binden, die ganz bestimmte chemische Eigenschaften
haben. Man unterscheidet Rezeptoren für Zellwachstum und -differenzierung,
immunologische Rezeptoren, Rezeptoren für Neurotransmitter (Botenstoffe
von Nervenzellen), immunologische Rezeptoren für die Zellerkennung,
Rezeptoren für Viren und bakterielle Giftstoffe (Toxine), Rezeptoren,
an denen bestimmte Pharmaka wirken und auf der cytoplasmatischen Seite
der Zellmembran Proteine mit Bindungsstellen für Zellskelettfilamente.
Die Bindung eines Liganten an seinen Rezeptor kann auf unterschiedliche
Weise zu Wirkungen führen:
A. Signaltransduktion:
Durch die spezifische Interaktion kommt es zu dreidimensionalen Veränderungen
der Proteinstruktur. Man unterscheidet 3 Typen von Rezeptorproteinen zur
Signaltransduktion:
Typ 1 Proteinphosphorylierung mit Tyrosinkinase: Nach
Bindung des Liganten an seinen Rezeptor wird unter ATP Verbrauch auf der
cytoplasmatischen Seite dieses Transmembranproteins ein anderes Protein
aktiviert (z.B. Insulinrezeptor)
Typ 2 ligantengesteuerter Ionenkanal (z.B. ein Neurotransmitter
wie Acetylcholin öffnet an einer Synapse
einen Natriumkanal);
Typ 3 durch G-Proteine gesteuerte Freisetzung von sekundären
Botenstoffen
(second messenger) wie z.B. cyclisches Adenosinmonophosphat (c-AMP), Innositoltriphosphat
(IP3) oder cyclisches Guanosinmonophosphat (c-GMP), hier wird über
intermolekulare Prozesse mit Nachbarmolekülen letztlich ein an der
Innenseite der Zellmembran gebundenes Enzym aktiviert.
B. rezeptorinduzierte Endocytose:
Hierbei kommt es zu einer Einstülpung der Zellmembran zur Aufnahme
von Molekülen ins Zellinnere.
Verbindungen von Zellmembranen:
Zellen sind besonders im Epithelgewebe
fest miteinander verbunden, um eine gute Stabilität zu erreichen.
An der Ausbildung solcher Zell-Zell Verbindungen ist die Zellmembran
beteiligt. Neben Verzahnungen finden
sich besonders differenzierte Kontaktstrukturen: Zonula
occludens und adhaerens, Fascia
adhaerens sowie Nexus und Desmosom.
Oberflächendifferenzierungen von
Zellen:
Zellen können mit Ausstülpungen ihrer Membran ihre
Oberfläche massiv vergrößern, was in resorbierenden Epithelien
zu beobachten ist. Die dabei ausgebildeten Strukturen bezeichnet man je
nach Aussehen und Funktion als unbewegliche Zellfortsätze, Mikrovilli
oder Stereocilien. Ferner sind auch die
beweglichen Zellfortsätze wie Kinocilien,
Geißeln
und Pseudopodien von Zellmembran überzogen.
Eine besonders dicke und elektronendichte Zellmembran findet man an den
dem Lumen anliegenden Abschnitten von Deckzellen im Übergangsepithel
(z.B. der Blase). An Synapsen
finden sich prä- und postsynaptische Verdichtungen der Zellmembran.
In glatten Muskelzellen,
Gefäßendothelzellen
und Haarzellen finden sich kleine rundliche Einstülpungen
des Extrazellularraumes in die Zellmembran, die Caveolen.
In den Stäbchen und Zapfen der Netzhaut
findet man dichte Stapel von eingestülpter Zellmembran, in denen die
Sehpigmente eingelagert sind.
--> Zelloberflächenspezialisierungen,
Mikrovilli,
Kinocilien,
Glycocalix,
Zell-Zell-Kontakte,
Epithelien,
Synapse,
gap
junction,
tight junction
--> Elektronenmikroskopischer Atlas Gesamtübersicht
--> Homepage des Workshops
Ein Bild wurde von HSD Dr. Klinger zur Verfügung
gestellt, übrige Aufnahmen, Seite & Copyright H. Jastrow.